Структура транспортной рнк. Виды рнк, функции и строение
Аминоацил-тРНК-синтетаза (АРСаза) - фермент синтетаза, катализирующий образование аминоацил-тРНК в реакции этерификации определенной аминокислоты с соответствующей ей молекулой тРНК. Для каждой аминокислоты существует своя аминоацил-тРНК-синтетаза. АРСазы обеспечивают соответствие нуклеотидным триплетам генетического кода (антикодону тРНК) встраиваемых в белок аминокислот, и, таким образом, обеспечивают правильность происходящего в дальнейшем считывания генетической информации с мРНК при синтезе белков на рибосомах. Большинство АРС-аз состоят из 1, 2 или 4 одинаковых полипептидных цепей. Молекулярная масса полипептидных цепей 30-140 тыс. Многие АРС-азы содержат два активных центра. Имеется 3 участка. 1-ый участок не обладает специфичностью, он одинаков для всех ферментов, это место присоединения АТФ. П-ой участок обладает строгой специфичностью, сюда присоединяется определенная АК, по которой и называется АРСаза, например, если она присоединяет метионин, то называется метионил-т-РНК-синтетаза. Ш-й участок также является строго специфичным участком, может соединиться только с опеределенной т-РНК. Таким образом, фермент необходим для узнавания аминокислоты и т-РНК.
Специфичность реакций, катализируемых АРС-азами, очень высока, что определяет точность белкового синтеза в живой клетке. Если А. осуществит ошибочное аминоацилирование тРНК близкой по структуре аминокислотой, произойдет коррекция путем катализируемого той же АРС-азы гидролиза ошибочных АК-тРНК до АК и тРНК. В цитоплазме содержится полный набор АРС-аз, в хлоропластах и митохондриях есть свои АРС-азы.
Транспортная РНК. Строение, функции. Строение рибосом.
Все тРНК имеют общие черты как в их первичной структуре, так и в способе складывания полинуклеотидной цепи во вторичную структуру за счет взаимодействий между основаниями нуклеотидных остатков.
Первичная структура тРНК
тРНК - относительно небольшие молекулы, длина их цепей варьирует от 74 до 95 нуклеотидных остатков. Все тРНК имеют одинаковый 3"-конец, построенный из двух остатков цитозина и одного - аденозина (CCA-конец). Именно 3"-концевой аденозин связывается с аминокислотным остатком при образовании аминоацил-тРНК. CCA-конец присоединяется ко многим тРНК с помощью специального фермента. Нуклеотидный триплет, комплементарный кодону для аминокислоты (антикодон), находится приблизительно в середине цепи тРНК. В отдельных положениях последовательности практически у всех видов тРНК встречаются одни и те же (консервативные) нуклеотидные остатки. В некоторых положениях могут находиться или только пуриновые, или только пиримидиновые основания (их называют полуконсервативными остатками).
Для всех молекул тРНК характерно присутствие большого числа (до 25% всех остатков) разнообразных модифицированных нуклеозидов, часто называемых минорными. Они образуются в различных местах молекул, во многих случаях четко определенных, в результате модификации обычных нуклеозидных остатков с помощью специальных ферментов.
Вторичная структура тРНК
складывания цепи во вторичную структуру происходит за счет взаимокомплементарности участков цепи. Три фрагмента цепи оказываются комплементарными при складывании их на себя, образуя шпилькообразные структуры. Кроме того, 5"-конец комплементарен участку, близкому к 3"-концу цепи, при их антипараллельном расположении; они формируют так называемый акцепторный стебель. В результате образуется структура, характеризующаяся наличием четырех стеблей и трех петель, которая получила название "клеверного листа". Стебель с петлей формируют ветвь. Внизу расположена антикодоновая ветвь, содержащая антикодоновый триплет в составе своей петли. Слева и справа от нее расположены D- и T-ветви, соответственно названные так из-за присутствия в их петлях необычных консервативных нуклеозидов дигидроуридина (D) и тимидина (T). Нуклеотидные последовательности всех изученных тРНК могут быть сложены в аналогичные структуры. В дополнение к трем петлям клеверного листа в структуре тРНК выделяют также дополнительную, или вариабельную, петлю (V-петлю). Ее размеры резко различаются у разных тРНК, варьируя, от 4 до 21 нуклеотида, а по последним данным, и до 24 нуклеотидов.
Пространственная (третичная) структура тРНК
За счет взаимодействия элементов вторичной структуры формируется третичная структура, которая получила название L-формы из-за сходства с латинской буквой L (рис. 2 и 3). За счет стэкинга оснований акцепторный стебель и T-стебель клеверного листа образуют одну непрерывную двойную спираль, а два других стебля - антикодоновый и D - другую непрерывную двойную спираль. При этом D- и T-петли оказываются сближенными и скрепляются между собой путем образования дополнительных, часто необычных пар оснований. В образовании этих пар, как правило, принимают участие консервативные или полуконсервативные остатки. Аналогичные третичные взаимодействия скрепляют и некоторые другие участки L-структуры
Основное назначение транспортной РНК (тРНК) - доставлять активированные остатки аминокислот в рибосому и обеспечивать их включение в синтезирующуюся белковую цепь в соответствии с программой, записанной генетическим кодом в матричной, или информационной, РНК (мРНК).
Строение рибосом.
Рибосомы представляют собой рибонуклео-протеиновые образования - своеобразные "фабрики", на которых идёт сборка аминокислот в белки. Эукариотические рибосомы имеют константу седиментации 80S и состоят из 40S (малой) и 60S (большой) субъединиц. Каждая субъединица включает рРНК и белки.
Белки входят в состав субъединиц рибосомы в количестве одной копии и выполняют структурную функцию, обеспечивая взаимодействие между мРНК и тРНК, связанными с аминокислотой или пептидом.
В присутствии мРНК 40S и 60S субъединицы объединяются с образованием полной рибосомы, масса которой примерно в 650 раз больше массы молекулы гемоглобина.
По-видимому, рРНК определяет основные структурные и функциональные свойства рибосом, в частности обеспечивает целостность рибосомных субъединиц, обусловливает их форму и ряд структурных особенностей.
Объединение большой и малой субъединицы происходит в присутствии матричной (информационной) РНК (мРНК). Одна молекула мРНК обычно объединяет несколько рибосом наподобие нитки бус. Такую структуру называют полисомой. Полисомы свободно располагаются в основном веществе цитоплазмы или прикреплены к мембранам шероховатой цитоплазматической сети. В обоих случаях они служат местом активного синтеза белка.
Так же как и эндоплазматическая сеть, рибосомы были открыты только с помощью электронного микроскопа. Рибосомы - самые маленькие из клеточных органелл.
В рибосоме есть 2 центра для присоединения молекул тРНК: аминоацильный (А) и пептидильный (Р) центры, в образовании которых участвуют обе субъединицы. Вместе центры А и Р включают участок мРНК, равный 2 кодонам. В ходе трансляции центр А связывает аа-тРНК, строение которой определяет кодон, находящийся в области этого центра. В структуре этого кодона зашифрована природа аминокислоты, которая будет включена в растущую полипептидную цепь. Центр Р занимает пептидил-тРНК, т.е. тРНК, связанная с пептидной цепочкой, которая уже синтезирована.
У эукариотов различают рибосомы 2 типов: "свободные", обнаруживаемые в цитоплазме клеток, и связанные с эндоплазматическим ретикулумом (ЭР). Рибосомы, ассоциированные с ЭР, ответственны за синтез белков "на экспорт", которые выходят в плазму крови и участвуют в обновлении белков ЭР, мембраны аппарата Гольджи, митохондрий или лизосом
Синтез полипептидной молекулы. Инициация и элонгация.
Синтез белка представляет собой циклический многоступенчатый энергозависимый процесс, в котором свободные аминокислоты полимеризуется в генетически детерминированную последовательность с образованием полипептидов.
Второй этап матричного синтеза белка, собственно трансляцию, протекающей в рибосоме, условно делят на три стадии: инициации, элонгации и терминации.
Инициация.
Последовательность ДНК, транскрибирующаяся в одну иРНК, начинающаяся просмотром на 5` конце и заканчивающаяся терминатором на 3`-конце, является единицей транскрипции и соответствует понятию «ген». Контроль экспрессии генов может осуществляться на этапе трансляции – инициация. На этом этапе РНК-полимераза распознает промотор – фрагмент длиной 41-44 п.н. Транскрипция происходит в направлении 5`-3`или слева направо. Последовательности, лежащие вправо от стартового нуклеитида, с которого начинается синтез тРНК, обозначаются номерами со знаком + (+1,+2..) а находящиеся левее со знаком – (-1,-2). Таким образом, область ДНК, к кторой присоединяется ДНК-полимераза, занимает участок с координатами примерно от -20 до +20. Во всех промоторах присутствуют одни и те же нуклеотидные последовательности., называемые консервативными. Такие последовательности служат сигналами, распознаваемыми РНК-полимеразами. Стартовая точка обычно представлена пурином. Сразу же влево от нее располагается 6-9 п.н., известные как последовательность (или ящик) Прибнова: ТАТААТ. Она может несколько варьировать, но первые два основания встреяаются в большинстве промоторов. Предполагается, что, поскольку ее образуют участок, богатый АТ-парами, связаны двумя водородными связями, ДНК в этом месте легче разделяется на отдельные нити. Это создает условия для функционирования РНК-полимеразы. Наряду с этим ящик Прибнова необходим для ориентирования таким образом, чтобы синтез иРНК шел слева направо т.е с 5`-3`. Центр ящика Прибнова находитя на нуклеотиде -10. Близкая по составу последовательность расположена в другом участке с центром в положении – 35.Этот участок состоящий из 9 п.н.обозначают как последовательность 35 или район распознавания. Он является сайтом, к которому присоединяется фактор, тем самым определяя эффективность, с которой РНК-полимераза не может начать транскрипцию без специальных белков. Одним из них служит фактор CAP или СRP.
У эукариот более подробно изучены промоторы, взаимодействующие с РНК-полимеразой II. Они содержат три гомологичных участка в районах с координатами в точках -25,-27 а также в стартовой точке. Стартовыми основаниями служат аденин, фланкированных с обеих сторон пиримидинами. На расстоянии 19-25 п.н. влево от участка расположены 7 п.н. ТАТАА, известны как последовательность ТАТА, или ящик «Хогнесса», часто он окружен участками, богатые ГЦ-парами. Еще левее в положении от -70 до -80 находится последовательность ГТЦ или ЦААТЦТ, называемая ящик ЦААТ. Предполагается, что последовательность ТАТА контролирует выбор стартового нуклеотида, а ЦААТ – первичное связывание РНК-полимеразы с ДНК-матрицей.
Элонгация. Стадия элонгации иРНК имеет сходства с элонгацией ДНК. В качестве предшественников для нее необходимы рибонуклеотидтрифосфаты. Этап элонгации транскрипции, то есть рост цепи иРНК, происходит путем присоединения рибонуклеотидмонофосфатов к 3`-концуцепи с освобождением пирофосфата. Копирование у эукариот обычно происходит на ограниченном участке ДНК (гене), хотя у прокариот в ряде случаев транскрипция может проходить последовательно через неколько сцепленных генов, формирующих единый оперон, и одного общего промотора. В таком случае образуется полицистронная иРНК.
Регуляция активности генов на примере лактозного оперона.
Лактозный оперон - полицистронный оперон бактерий, кодирующий гены метаболизма лактозы.
Регуляция экспрессии генов метаболизма лактозы у кишечной палочки была впервые описана в 1961 году учеными Ф. Жакобом и Ж. Моно. Бактериальная клетка синтезирует ферменты, принимающие участие в метаболизме лактозы, лишь в том случае, когда лактоза присутствует в окружающей среде и клетка испытывает недостаток глюкозы.
Лактозный оперон состоит из трех структурных генов, промотора, оператора и терминатора. Принимается, что в состав оперона входит также ген-регулятор, который кодирует белок-репрессор.
Структурные гены лактозного оперона - lacZ, lacY и lacA:
lacZ кодирует фермент β-галактозидазу, которая расщепляет дисахарид лактозу на глюкозу и галактозу,
lacY кодирует β-галактозид пермеазу, мембранный транспортный белок, который переносит лактозу внутрь клетки.
lacA кодирует β-галактозид трансацетилазу, фермент, переносящий ацетильную группу от ацетил-КoA на бета-галактозиды.
В начале каждого оперона находится специальный ген - ген оператор. На структурных генах одного оперона обычно образуется одна м-РНК, и эти гены бывают одновременно активны или неактивны. Как правило, структурные гены в опероне находятся в состоянии репрессии.
Промотор - участок ДНК, опознаваемый ферментом РНК- полимеразой, обеспечивающим синтез м-РНК в опероне предшествует участок ДНК, к которому присоединяется Сар-белок - белок активатор. Эти два участка ДНК состоят из 85 нуклеотидных пар. После промотора в опероне размещается ген - оператор, состоящий из 21 нуклеотидной пары С ним обычно и бывает связан белок - репрессор, вырабатываемый геном-регулятором За геном-оператором располагается спейсер (space -промежуток). Спейсеры - неинформативные участки молекулы ДНК различной длины (иногда до 20000 пар оснований), которые, по видимому, принимают участие в регулировании процесса транскрипции соседнего гена.
Заканчивается оперон терминатором - небольшим участком ДНК, который служит стоп-сигналом синтеза м-РНК на данном опероне.
Акцепторные гены служат местом прикрепления различных белков, регулирующих работу структурных генов. Если лактоза, проникая в клетку (ее в данном случае называют индуктором), блокирует белки, кодируемые геном-регулятором, то они теряют способность присоединяться к гену-оператору. Ген-оператор переходит в активное состояние и включает в работу структурные гены.
РНК-полимераза с помощью Cap-белка (белка-активатора) присоединяется к промотору и, продвигаясь по оперону, синтезирует про-м-РНК. При транскрипции м-РНК считывает генетическую информацию со всех структурных генов в одном опероне. При трансляции на рибосоме происходит синтез нескольких разных полипептидных цепей, в соответствии с содержащимися в м-РНК кодонами - последовательностями нуклеотидов, обеспечивающих инициацию и терминацию трансляции каждой цепи. Тип регуляции работы генов, рассмотренной на примере лактозного оперона, называется негативной индукцией синтеза белка.
Регуляция активности генов на примере триптофанового оперона.
Другим типом регуляции работы генов служит негативная репрессия, изученная у E.coU на примере оперона, контролирующего синтез аминокислоты триптофона. Этот оперон состоит из 6700 пар нуклеотидов и содержит 5 структурных генов, ген оператор и два промотора. Ген регулятор обеспечивает постоянный синтез регуляторного белка, который не влияет на работу trp - оперона. При избытке в клетке триптофана последний соединяется с регуляторным белком и изменяет его таким образом, что он связывается с о перо ном и репрессирует синтез соответствующей м-РНК.
Негативный и позитивный контроль генетической активности.
Известна также и так называемая позитивная индукция, когда белковый продукт гена-регулятора активирует работу оперона, т.е. является не репрессором, а активатором Деление это условно, и строение акцепторной части оперона, действие гена - регулятора у прокариот весьма разнообразны.
Число структурных генов в опероне у прокариот колеблется от одного до двенадцати; оперон может иметь либо один, либо два промотора и терминатора. Все структурные гены, локализованные в одном опероне, как правило, контролируют систему ферментов, обеспечивающих одну цепь биохимических реакций. Несомненно, что в клетке существуют системы, согласующие регуляцию работы нескольких оперонов.
К первой части акцептора гена - оператора присоединяются белки, активирующие синтез м-РНК, а к концу его - белки - репрессоры, подавляющие синтез м-РНК. Один ген регулируется одним из нескольких белков, каждый из которых прикрепляется к соответствующей точке акцептора. Разные же гены могут иметь общие регуляторы и одинаковые операторные участки. Гены - регуляторы действуют не одновременно. Сначала один включает сразу одну группу генов, затем через некоторое время другой - другую группу, т.е. регуляция активности генов происходит «каскадами», причем белок синтезированный в одной стадии, может быть регулятором синтеза белков следующей стадии.
Строение хромосом. Кариотип. Идиограмма. Модели строения хромосом.
Хромосомы эукариот имеют сложное строение. Основу хромосомы составляет линейная (не замкнутая в кольцо) макромолекула дезоксирибонуклеиновой кислоты (ДНК) значительной длины (например, в молекулах ДНК хромосом человека насчитывается от 50 до 245 миллионов пар азотистых оснований). В растянутом виде длина хромосомы человека может достигать 5 см. Помимо неё, в состав хромосомы входят пять специализированных белков - H1, H2A, H2B, H3 и H4 (так называемые гистоны) и ряд негистоновых белков. Последовательность аминокислот гистонов высококонсервативна и практически не различается в самых разных группах организмов. В интерфазе хроматин не конденсирован, но и в это время его нити представляют собой комплекс из ДНК и белков. Хроматин представляет собой дезоксирибонуклеопротеид, выявляемый под световым микроскопом в виде тонких нитей и гранул. Макромолекула ДНК обвивает октомеры (структуры, состоящую из восьми белковых глобул) гистоновых белков H2A, H2B, H3 и H4, образуя структуры, названные нуклеосомами.
В целом вся конструкция несколько напоминает бусы. Последовательность из таких нуклеосом, соединённых белком H1, называется нуклеофиламентом, или нуклеосомной нитью, диаметром около 10 нм.
Конденсированная хромосома имеет вид буквы X (часто с неравными плечами), поскольку две хроматиды, возникшие в результате репликации, по-прежнему соединены между собой в районе центромеры. Каждая клетка тела человека содержит в точности 46 хромосом. Хромосомы всегда парны. В клетке всегда имеется по 2 хромосомы каждого вида, пары отличаются друг от друга по длине, форме и наличию утолщений или перетяжек.
Центромера - особым образом организованный участок хромосомы, общий для обеих сестринских хроматид. Центромера делит тело хромосомы на два плеча. В зависимости от расположения первичной перетяжки различают следующие типы хромосом: равноплечие (метацентрические), когда центромера расположена посередине, а плечи примерно равной длины; неравноплечие (субметацентрические), когда центромера смещена от середины хромосомы, а плечи неравной длины; палочковидные (акроцентрические), когда центромера смещена к одному концу хромосомы и одно плечо очень короткое. В некоторых хромосомах могут быть вторичные перетяжки, отделяющие от тела хромосомы участок, называемый спутником.
Изучение химической организации хромосом эукариотических клеток показало, что они состоят в основном из ДНК и белков. Как было доказано многочисленными исследованиями, ДНК является материальным носителем свойств наследственности и изменчивости и заключает в себе биологическую информацию - программу развития клетки, организма, записанную с помощью особого кода. Белки составляют значительную часть вещества хромосом (около 65% массы этих структур). Хромосома как комплекс генов представляет собой эволюционно сложившуюся структуру, свойственную всем особям данного вида. Взаимное расположение генов в составе хромосомы играет немаловажную роль в характере их функционирования..
Графическое изображение кариотипа, показывающие его структурные особенности, называется идиограммой.
Специфический для определенного вида по числу и структуре набор хромосом получил название кариотипа.
Гистоны. Структура нуклеосом.
Гистоны - основной класс нуклеопротеинов, ядерных белков, необходимых для сборки и упаковки нитей ДНК в хромосомы. Существует пять различных типов гистонов, названных H1/Н5, H2A, H2B, H3, H4. Последовательность аминокислот в этих белках практически не различается в организмах различного уровня организации. Гистоны - небольшие, сильно основные белки, связывающиеся непосредственно с ДНК. Гистоны принимают участие в структурной организации хроматина, нейтрализуя за счет положительных зарядов аминокислотных остатков отрицательно заряженные фосфатные группы ДНК, что делает возможной плотную упаковку ДНК в ядре.
По две молекулы каждого из гистонов Н2А, Н2В, Н3 и Н4 составляют октамер, обвитый сегментом ДНК длиной 146 п.о., образующим 1,8 витка спирали поверх белковой структуры. Эта частица диаметром 7 нм называется нуклеосомой. Участок ДНК (линкерная ДНК), непосредственно не контактирующий с гистоновым октамером, взаимодействует с гистоном Н1.
Группа негистоновых белков высоко гетерогенна и включает структурные ядерные белки, множество ферментов и факторов транскрипции, связанных с определенными участками ДНК и осуществляющих регуляцию генной экспрессии и других процессов.
Гистоны в октамере имеют подвижный N-концевой фрагмент («хвост») из 20 аминокислот, который выступает из нуклеосом и важен для поддержания структуры хроматина и контроля за генной экспрессией. Так, например, формирование (конденсация) хромосом связано с фосфорилированием гистонов, а усиление транскрипции - с ацетилированием в них остатков лизина. Детали механизма регуляции до конца не выяснены.
Нуклеосома - субъединица хроматина, состоящая из ДНК и набора из четырех пар гистоновых белков Н2А, Н2В, Н3 и Н4 одной молекулы гистона H1. Гистон Н1 связывается с линкерной ДНК между двумя нуклеосомами.
Нуклеосома является элементарной единицей упаковки хроматина. Она состоит из двойной спирали ДНК, обмотанной вокруг специфического комплекса из восьми нуклеосомных гистонов (гистонового октамера). Нуклеосома представляет собой дисковидную частицу с диаметром около 11 нм, содержащую по две копии каждого из нуклеосомных гистонов (Н2A, Н2В, НЗ, Н4). Гистоновый октамер образует белковую сердцевину, вокруг которой дважды обмотана двуспиральная ДНК (146 нуклеотидных пар ДНК на гистоновый октамер).
Нуклеосомы, входящие в состав фибрилл, расположены более или менее равномерно вдоль молекулы ДНК на расстоянии 10-20 нм друг от друга.
Уровни упаковки хромосом эукариот. Конденсация хроматина.
Таким образом, уровни упаковки ДНК следующие:
1) Нуклеосомный (2,5 оборота двуспиральной ДНК вокруг восьми молекул гистоновых белков).
2) Супернуклеосомный - хроматиновая спираль (хромонема).
3) Хроматидный - спирализованная хромонема.
4) Хромосома - четвертая степень сперализации ДНК.
В интерфазном ядре хромосомы деконденсированы и представлены хроматином. Деспирализованный участок, содержащий гены, называется эухроматин (разрыхленный, волокнистый хроматин). Это необходимое условие для транскрипции. Во время покоя между делениями определенные участки хромосом и целые хромосомы остаются компактными.
Эти спирализованные, сильно окрашивающиеся участки, называются гетерохроматином. Они неактивны в отношении транскрипции. Различают факультативный и конститутивный гетерохроматин.
Факультативный гетерохроматин информативен, т.к. содержит гены и может переходить в эухроматин. Из двух гомологичных хромосом одна может гетерохроматической. Конститутивный гетерохроматин всегда гетерохроматичен, неиформативен (не содержит генов) и поэтому всегда неактивен в отношении транскрипции.
Хромосомная ДНК состоит из более 108 пар оснований, из которых образуется информативные блоки - гены, расположенные линейно. На их долю приходится до 25% ДНК. Ген - функциональная единица ДНК, содержащая информацию для синтеза полипептидов, или всех РНК. Между генами находятся спейсеры - неинформативные отрезки ДНК разной длины. Избыточные гены представлены большим числом - 104 идентичных копий. Примером являются гены для т-РНК, р-РНК, гистонов. В ДНК встречаются последовательности одних и тех же нуклеотидов. Они могут быть умеренно повторяющимися и высоко повторяющимися последовательностями. Умеренно повторяющиеся последовательности достигают 300 пар нуклеотидов с повторениями 102 - 104 и представляют чаще всего спейсеры, избыточные гены.
Высокоповторяющиеся последовательности (105 - 106) образуют конститутивный гетерохроматин. Около 75% всего хроматина не участвует в транскрипции, он приходится на высокоповторяющиеся последовательности и нетранскрибируемые спейсеры.
Приготовление хромосомных препаратов. Использование колхицина. Гипотония, фиксация и окрашивание.
В зависимости от степени пролиферативной активности клеток разных тканей in vivo и in vitro различают прямые и непрямые методы получения препаратов хромосом.
1) Прямые методы используются при исследовании тканей, обладающих высокой митотической активностью (костный мозг, хорион и плацента, клетки лимфатических узлов, ткани эмбриона на ранней стадии развития). Препараты хромосом готовятся непосредственно из свежеполученного материала после специальной обработки.
2) Непрямые методы включают получение препаратов хромосом из любой ткани после ее предварительного культивирования в течение различного периода времени.
Существует множество модификаций прямого и непрямого методов приготовления хромосомных препаратов, однако основные этапы получения метафазных пластинок остаются неизменными:
1. Использование колхицина (колцемида) - ингибитора образования митотического веретена, который останавливает деление клеток на стадии метафазы.
2. Гипотонический шок с использованием растворов солей калия или натрия, которые вследствие разницы осмотического давления внутри и снаружи клеток вызывают их набухание и разрыв межхромосомных связей. Такая процедура приводит к отделению хромосом друг от друга, способствуя более сильному их разбросу в метафазных пластинках.
3. Фиксация клеток с использованием ледяной уксусной кислоты и этанола (метанола) в соотношении 3:1 (фиксатор Карнуа), что способствует сохранению структуры хромосом.
4. Раскапывание суспензии клеток на предметные стекла.
5. Окрашивание хромосомных препаратов.
Разработан ряд методов окрашивания (бэндинга), позволяющих выявить комплекс поперечных меток (полос, бэндов) на хромосоме. Каждая хромосома характеризуется специфическим комплексом полос. Гомологичные хромосомы окрашиваются идентично, за исключением полиморфных районов, где локализуются разные аллельные варианты генов. Аллельный полиморфизм характерен для многих генов и встречается в большинстве популяций. Выявление полиморфизмов на цитогенетическом уровне не имеет диагностического значения.
А. Q-окрашивание. Первый метод дифференциального окрашивания хромосом был разработан шведским цитологом Касперссоном, использовавшим с этой целью флюоресцентный краситель акрихин-иприт. Под люминесцентным микроскопом на хромосомах видны участки с неодинаковой интенсивностью флюоресценции - Q-сегменты. Метод лучше всего подходит для исследования Y-хромосом и потому используется для быстрого определения генетического пола, выявления транслокаций (обменов участками) между X- и Y-хромосомами или между Y-хромосомой и аутосомами, а также для просмотра большого числа клеток, когда необходимо выяснить, имеется ли у больного с мозаицизмом по половым хромосомам клон клеток, несущих Y-хромосому.
Б. G-окрашивание. После интенсивной предварительной обработки, часто с применением трипсина, хромосомы окрашивают красителем Гимзы. Под световым микроскопом на хромосомах видны светлые и темные полосы - G-сегменты. Хотя расположение Q-сегментов соответствует расположению G-сегментов, G-окрашивание оказалось более чувствительным и заняло место Q-окрашивания в качестве стандартного метода цитогенетического анализа. G-окрашивание дает наилучшие результаты при выявлении небольших аберраций и маркерных хромосом (сегментированных иначе, чем нормальные гомологичные хромосомы).
В. R-окрашивание дает картину, противоположную G-окрашиванию. Обычно используют краситель Гимзы или флюоресцентный краситель акридиновый оранжевый. Этим методом выявляют различия в окрашивании гомологичных G- или Q-негативных участков сестринских хроматид или гомологичных хромосом.
Г. C-окрашивание используют для анализа центромерных районов хромосом (эти районы содержат конститутивный гетерохроматин) и вариабельной, ярко флюоресцирующей дистальной части Y-хромосомы.
Д. T-окрашивание применяют для анализа теломерных районов хромосом. Эту методику, а также окрашивание районов ядрышковых организаторов азотнокислым серебром (AgNOR-окрашивание) используют для уточнения результатов, полученных путем стандартного окрашивания хромосом.
Учебника. Несмотря на то, что тРНК значительно мельче, рассказ о ее строении, особенностях и функционировании заслуживает отдельной главы.
Итак, тРНК является «адаптером», который одним своим концом распознает трехбуквенную последовательность генетического кода, сопоставляя ей единственную соответствующую аминокислоту, закрепленную на другом конце тРНК. На прикасающемся к матричной РНК конце транспортной РНК находятся 3 нуклеотида, образующие антикодон . Только в случае комплементарности антикодона к участку мРНК транспортная РНК может к ней присоединиться. Но даже в этом случае тРНК не может присоединиться к мРНК самостоятельно, ей необходима помощь рибосомы, которая является местом их взаимодействия, а также активным участником трансляции. Например, именно рибосома создает связи между принесенными тРНК аминокислотами, формируя протеиновую цепочку.
Особенности строения тРНК обусловлены генетическим кодом, то есть правилами построения протеина по гену, которые транспортная РНК прочитывает. Этот код работает в каждом из живущих на Земле существ: создание вируса записано теми же трехбуквенными кодонами, которые используются для записи «инструкции по сборке» дельфина. Экспериментально проверено, что гены одного живого существа, помещенные в клетку другого, отлично копируются и транслируются в протеины, не отличимые от воспроизводящихся в клетках хозяина генов. На единообразии генетического кода основано производство колониями модифицированных кишечных палочек инсулина и многих других человеческих ферментов, использующихся в качестве лекарств для людей, чей организм не способен их вырабатывать, или вырабатывает недостаточно. Несмотря на очевидную разницу между человеком и кишечной палочкой, протеины человека легко создаются по его чертежам с помощью копировального аппарата кишечной палочки. Неудивительно, что транспортные РНК разных существ отличаются весьма незначительно.

Каждый кодон из этого списка, за исключением трех стоп-кодонов , дающих сигнал о завершении трансляции, должен распознаваться транспортной РНК. Узнавание осуществляется с помощью присоединения к матричной РНК антикодона, который может связаться только с одним кодоном из списка, поэтому тРНК может распознать только один кодон. А значит, в клетке существует как минимум 61 вид этих молекул. На самом деле их даже больше, так как в некоторых ситуациях для считывания матричной РНК недостаточно просто иметь нужный антикодон: требуется выполнение других условий, в соответствии с которыми создается особая, модифицированная тРНК.
На первый взгляд, такое разнообразие тРНК должно существенно осложнять процесс трансляции: ведь каждая из этих молекул будет проверять подставленный ей рибосомой кодон матричной РНК на соответствие своему антикодону — казалось бы, столько бессмысленной механической работы, столько впустую затраченного времени и энергии. Но в результате эволюции сформировались также и клеточные механизмы, предотвращающие эту проблему. Например, количество тРНК каждого вида в клетке соответствует тому, как часто аминокислота, несомая этим видом, встречается в строящихся протеинах. Есть аминокислоты, которые редко используются клеткой, а есть часто использующиеся, и если бы количество несущих их тРНК было одинаковым, это значительно осложнило бы сборку протеинов. Поэтому «редких» аминокислот и соответствующих им тРНК в клетке мало, а часто встречающиеся производятся в большом количестве.

При таком разнообразии молекул тРНК все они очень похожи, поэтому рассматривая их строение и функции, в основном мы будем изучать общие для всех видов черты. Если взглянуть на трехмерную схему тРНК, она кажется плотным нагромождением атомов. Кажется невероятным, что эта сложнозакрученная молекула получена в результате сворачивания длинной цепи нуклеотидов, но именно так она и образуется.
Можно проследить этапы ее образования, начиная с самого первого: составления РНК-полимеразой последовательности нуклеотидов в соответствии с геном, содержащим информацию о данной транспортной РНК. Порядок следования друг за другом этих нуклеотидов и их количество называется первичной структурой тРНК . Получается, что именно первичная структура тРНК закодирована в гене, прочитываемом РНК-полимеразой. Вообще первичной структурой называют последовательность сравнительно простых молекул одного типа, из которых составлена более сложная, свернутая молекула-полимер. Например, первичной структурой молекулы протеина является простая последовательность составляющих ее аминокислот.

Любая цепочка нуклеотидов не может находиться в клетке в развернутом состоянии, просто вытянувшись в линию. На краях нуклеотидов находится слишком много положительно и отрицательно заряженных частей, которые легко образуют водородные связи друг с другом. Про то, как такие же связи образуются между нуклеотидами двух молекул ДНК, соединяя их в двойную спираль, рассказано в , а за подробностями о водородных связях можно залезть в . Водородные связи менее прочны, чем связи между атомами в молекулах, но их достаточно для того, чтобы причудливо скрутить нить тРНК и держать ее в таком положении. Сначала эти связи образуются только между некоторыми нуклеотидами, сворачивая тРНК в фигуру наподобие листа клевера. Результат этого начального свертывания называют вторичной структурой тРНК . На схеме слева видно, что только некоторые нуклеотиды связываются водородными связями, а другие остаются неспаренными, образуя кольца и петли. Различия между вторичной структурой разных видов тРНК обусловлены различиями в их первичной структуре. Проявляется это в разной длине «клеверных листов» или «стебелька» за счет разной длины исходной цепочки нуклеотидов.
Другим отличием первичной структуры разных тРНК является то, что только в некоторых позициях у них стоят одни и те же нуклеотиды (на схеме вверху они отмечены первыми буквами своих названий), большинство же нуклеотидов у разных тРНК отличаются друг от друга. Приведенная выше схема является общей для всех тРНК, поэтому отличающиеся нуклеотиды отмечены числами.
Главными функциональными частями тРНК являются:
=) антикодон , то есть последовательность нуклеотидов, комплементарная единственному кодону матричной РНК, находящаяся на антикодоновой шпильке
=) акцепторный конец , к которому может быть присоединена аминокислота. Он находится с противоположной стороны от антикодоновой шпильки.
В реальности ни одна тРНК не выглядит так, как на схеме вторичной структуры, потому что для ее образования соединились между собой только некоторые нуклеотиды, а остальные остались неспаренными. За счет образования водородных связей между нуклеотидами из разных частей листа клевера он сворачивается дальше в гораздо более сложную третичную структуру в форме буквы L. Ты можешь понять, как именно изогнулись разные части вторичной структуры для образования третичной, сопоставив цвета на их схемах ниже. Антикодоновая шпилька, обозначенная голубым и серым цветами, остается внизу (стоит помнить, что это «внизу» является условным: удобно изображать тРНК именно в такой пространственной ориентации в схемах трансляции белка), а акцепторный конец (желтого цвета) загнут в сторону.

Именно так выглядит тРНК, готовая к присоединению аминокислоты. Самостоятельно соединиться с аминокислотой тРНК не способна, для этого требуется участие специального фермента: аминоацил-тРНК-синтетазы . Число видов синтетаз в клетке совпадает с числом видов тРНК.
Единообразие формы всех видов тРНК необходимо для того, чтобы рибосома могла распознавать любую из них, способствовать их стыковке с мРНК, перемещать внутри себя из одного сайта в другой. Если бы разные виды тРНК существенно отличались друг от друга, это чрезвычайно затруднило бы работу рибосомы, критически снизив скорость синтеза протеина. Естественный отбор таким образом направлен на то, чтобы сделать тРНК похожими друг на друга. Но вместе с тем есть и другой фактор, требующий существования заметных различий между разными видами тРНК: ведь необходимо распознать каждый вид и прикрепить к нему единственную, соответствующую ему аминокислоту. Очевидно, что эти отличия должны быть хоть и заметными, но не слишком существенными, так что работа по распознаванию видов тРНК превращается в ювелирный процесс. И именно его осуществляют аминоацил-тРНК-синтетазы: каждая из них может связаться только с одной из 20 аминокислот и присоединить ее именно к тем видам тРНК, которые этой аминокислоте соответствуют. Из таблицы с генетическим кодом видно, что каждая аминокислота кодируется несколькими последовательностями нуклеотидов, поэтому например все четыре тРНК с антикодонами CGA, CGG, CGU и CGC будут распознаваться одной и той же синтетазой, присоединяющей к ним аланин. Такие обрабатываемые одной синтетазой тРНК называются родственными .
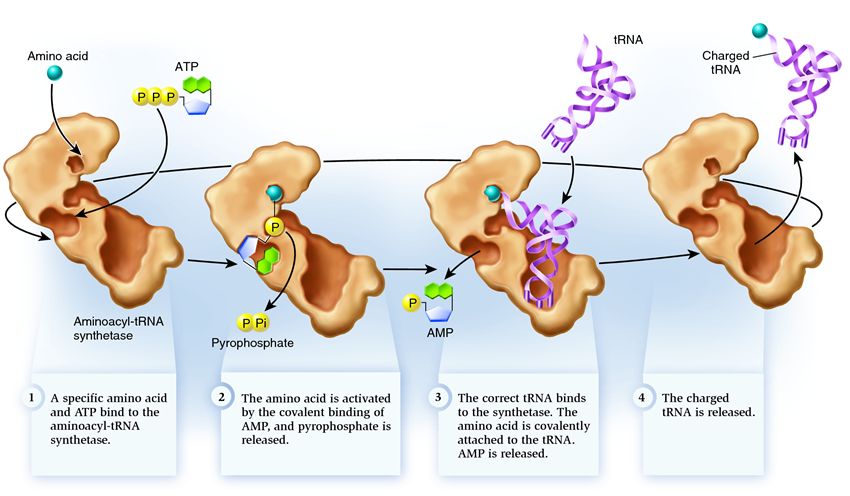
Синтетаза принадлежит к группе ферментов, чья функция заключается в связывании с отдельно существующими молекулами и объединении их в одну:
1 . синтетаза соединяет аминокислоту и молекулу АТФ. От АТФ отрываются две фосфатные группы, высвобождая энергию, необходимую для следующих действий. Остающийся от разрушенной молекулы аденозинмонофосфат (АМФ) присоединяется к аминокислоте, подготовив ее к соединению с акцепторной шпилькой.
2 . синтетаза присоединяет к себе одну из соответствующих этой аминокислоте родственных тРНК.

На этом этапе происходит проверка соответствия транспортной РНК синтетазе. Существует несколько способов распознавания, и в каждой синтетазе имеется уникальная их комбинация. Во взаимодействии синтетазы и тРНК участвует как минимум один нуклеотид антикодона. Так же требует проверки акцепторная шпилька: определяется наличие на ней специфических нуклеотидов, общих для соответствующих нужной аминокислоте родственных тРНК. Нуклеотиды других частей тРНК тоже могут участвовать в проверке соответствия, соединяясь с определенными местами синтетазы. Неправильная тРНК может совпадать с нужной по каким-то параметрам, но из-за неполного совпадения будет присоединяться к синтетазе медленно и неплотно, легко отваливаясь. А правильная тРНК прилипнет к синтетазе быстро и крепко, в результате чего структура синтетазы меняется, запуская процесс аминоацилирования , то есть присоединения аминокислоты к тРНК.

3 . аминоацилирование заключается в замене присоединенной к аминокислоте молекулы АМФ на молекулу тРНК. После этой замены АМФ покидает синтетазу, а тРНК задерживается для последней проверки аминокислоты. Если присоединенная аминокислота опознается как неправильная, она будет отсоединена от тРНК, место аминокислоты в синтетазе опустеет, и туда сможет присоединиться другая молекула. Новая аминокислота пройдет стадии соединения с АТФ и тРНК, и тоже подвергнется проверке. Если же ошибок допущено не было, заряженная аминокислотой тРНК освобождается: она готова сыграть свою роль в трансляции протеина. А синтетаза готова присоединить новые аминокислоту и тРНК, и цикл начнется заново.
От правильности работы аминоацил-тРНК-синтетазы зависит многое: если на этом этапе произойдет сбой, то к тРНК будет присоединена неверная аминокислота. И она будет встроена в растущий на рибосоме протеин, ведь тРНК и рибосома не имеют функции проверки соответствия кодона и аминокислоты. Последствия ошибки могут быть незначительными или катастрофическими, и в ходе естественного отбора существа с ферментами, не имеющими функции таких проверок, были вытеснены более приспособленными, имеющими различные варианты установления соответствия между аминокислотой и тРНК. Поэтому в современных клетках синтетаза соединяется с неверной аминокислотой в среднем в одном случае из 50 тысяч, а с ошибочной тРНК всего лишь один раз на 100 тысяч присоединений.

Некоторые аминокислоты отличаются друг от друга всего лишь несколькими атомами. Если взглянуть на их схемы, становится очевидно, что вероятность перепутать аргинин с аланином гораздо меньше, чем принять изолейцин за лейцин или валин. Поэтому у каждой синтетазы, связывающейся с одной из похожих друг на друга аминокислот, имеются дополнительные механизмы проверки. Вот пример такого приспособления у изолейцин-тРНК-синтетазы:

У каждой синтетазы существует синтетический центр , в котором происходит присоединение аминокислоты к тРНК. Акцепторная шпилька тРНК, захваченной синтетазой, попадает именно туда, так же как и аминокислота, готовая вступить в реакцию с ней. Работа некоторых синтетаз заканчивается сразу после соединения аминокислоты и тРНК. Но Ile-тРНК-синтетаза имеет повышенную вероятность совершения ошибок из-за существования других похожих на изолейцин аминокислот. Поэтому у нее есть еще и коррекционный центр : из названия понятно, какую роль он играет в процессе соединения тРНК и аминокислоты. На рисунке справа видно, что положение конца акцепторной шпильки тРНК в синтетическом центре Ile-тРНК-синтетазы придает этой шпильке неестественный изгиб. Тем не менее, синтетаза удерживает тРНК в таком положении до момента присоединения к ней аминокислоты. После того, как это соединение произошло, необходимость нахождения акцепторной шпильки в синтетическом центре исчерпана, и тРНК распрямляется, попадая своим концом с насаженной на него аминокислотой в коррекционный центр.

Конечно же, синтетический центр тоже играет свою роль в отсеивании не подходящих синтетазе аминокислот. Чтобы попасть в него, молекуле необходимо отвечать ряду условий, в том числе иметь подходящий размер. Несмотря на то, что лейцин и изолейцин содержат одно и то же количество атомов, из-за различий в пространственной структуре лейцин крупнее. Поэтому он не может проникнуть в синтетический центр, размеры которого соответствуют более компактному изолейцину, и просто отскакивает от Ile-тРНК-синтетазы.
Но вот валин, являющийся самой мелкой из этих трех молекул со схожей атомной структурой, легко занимает место изолейцина в синтетическом центре, и синтетаза присоединяет его к тРНК. Именно в этом случае вступает в игру коррекционный центр синтетазы. Если распрямляющаяся акцепторная шпилька заряжена верно и несет изолейцин, то она не может протиснуться внутрь коррекционного центра: он просто слишком мал для этой молекулы. Таким образом, распрямившуюся тРНК больше ничто не держит, и она отсоединяется от синтетазы. А вот если к тРНК присоединен валин, он проскальзывает в коррекционный центр, тем самым удерживая соединенную с ним тРНК в синтетазе. Такое излишне длительное нахождение тРНК внутри является для синтетазы сигналом ошибки, меняя ее пространственную конфигурацию. В результате этого:
=) валин отсоединяется от тРНК и удаляется из синтетазы
=) акцепторная шпилька возвращается в синтетический центр, ожидая присоединения к аминокислоте
=) синтетаза связывается с новой аминокислотой, «заряжает» ей тРНК и снова проверяет, был ли использован для этого именно изолейцин.
Схожий механизм двойного распознавания используется и другими синтетазами.
Синтез предшественников рРНК и тРНК сходен с синтезом ире-мРНК. Первичный транскрипт рибосомных РНК не содержит интронов, и при действии специфических РНКаз расщепляется с образованием 28S-, 18S- и 5,8S-pPHK; 5S-pPHK синтезируется при участии РНК-полимеразы III.
рРНК и тРНК.
Первичные транскрипты тРНК превращаются в зрелые формы также путем частичного гидролиза.
Все типы РНК участвуют в биосинтезе белков, но их функции в этом процессе различны. Роль матрицы, определяющей первичную структуру белков, выполняют матричные РНК (мРНК).Важное значение для изучения механизмов трансляции имеет использование бесклеточных систем биосинтеза белков. Если инкубировать гомогенаты тканей со смесью аминокислот, из которых хотя бы одна меченая, то по включению метки в белки можно регистрировать биосинтез белков. Первичная структура синтезируемого белка определяется первичной структурой мРНК, добавленной в систему. Если бесклеточная система составлена с глоби-новой мРНК (ее можно выделить из ретикулоцитов), синтезируется глобин (а- и (3-цепи глобина); если с альбуминовой мРНК, выделяемой из гепатоцитов, синтезируется альбумин, и т. д.
14. Значение репликации:
а) процесс является важным молекулярным механизмом, лежащим в основе всех разновидностей деления клеток проэукариот, б) обеспечивает все типы размножения как одноклеточных, так и многоклеточных организмов,
в) поддерживает постоянство клеточного
состава органов, тканей и организма в результате физиологической регенерации
г) обеспечивает длительное существование отдельных индивидуумов;
д) обеспечивает длительное существование видов организмов;
е) процесс способствует точному удвоениюинформации;
ж) в процессе репликации возможны ошибки (мутации) , что может приводить к нарушениям синтеза белков с развитием патологических изменений.
Уникальное свойство молекулы ДНК удваиваться перед делением клетки называется репликацией.
Особые свойства нативной ДНК как носителя наследственной информации:
1) реплицирование – образование новых цепей комплиментарно;
2) самокоррекция – ДНК-полимераза отщепляет ошибочно реплицированные участки (10-6);
3) репарация - восстановление;
Осуществление этих процессов происходит в клетке с участием специальных ферментов.
Как устроена система репарации Эксперименты, позволившие выявить механизмы восстановления и само существование этой способности, проводились с помощью одноклеточных организмов. Но процессы репарации присущи живым клеткам животных и человека. Некоторые люди страдают пигментной ксеродермой. Это заболевание вызвано отсутствием способности клеток ресинтезировать поврежденную ДНК. Ксеродерма передается по наследству. Из чего же состоит репарационная система? Четыре фермента, на которых держится процесс репарации – это ДНК-хеликаза, -экзонуклеаза, -полимераза и -лигаза. Первый из этих соединений способен распознавать повреждения в цепи молекулы дезоксирибонуклеиновой кислоты. Он не только распознает, но и обрезает цепь в нужном месте, чтобы удалить измененный отрезок молекулы. Само устранение осуществляется с помощью ДНК-экзонуклеазы. Далее происходит синтез нового участка молекулы дезоксирибонуклеиновой кислоты из аминокислот с целью полностью заменить поврежденный отрезок. Ну и финальный аккорд этой сложнейшей биологической процедуры совершается с помощью фермента ДНК-лигазы. Он отвечает за прикрепление синтезированного участка к поврежденной молекуле. После того как все четыре фермента сделали свою работу, молекула ДНК полностью обновлена и все повреждения остаются в прошлом. Вот так слаженно работают механизмы внутри живой клетки.
Классификация На данный момент ученые выделяют следующие разновидности систем репарации. Они активируются в зависимости от разных факторов. К ним относятся: Реактивация. Рекомбинационное восстановление. Репарация гетеродуплексов. Эксцизионная репарация. Воссоединение негомологичных концов молекул ДНК. Все одноклеточные организмы обладают как минимум тремя ферментными системами. Каждая из них обладает способностью осуществлять процесс восстановления. К этим системам относят: прямую, эксцизионную и пострепликативную. Этими тремя видами восстановления ДНК обладают прокариоты. Что касается эукариот, то в их распоряжении находятся дополнительные механизмы, которые называются Miss-mathe и Sos-репарация. Биология подробно изучила все эти виды самовосстановления генетического материала клеток.
15. Генети́ческий код - это свойственный всем живым организмам способ кодирования аминокислотной последовательности белков при помощи последовательности нуклеотидов. Аминокислотная последовательность в молекуле белка зашифрована в виде нуклеотидной последовательности в молекуле ДНК и называется генетическим кодом. Участок молекулы ДНК, ответственный за синтез одного белка, называется геном.
В ДНК используется четыре нуклеотида - аденин (А), гуанин (G), цитозин (С), тимин (T), которые в русскоязычной литературе обозначаются буквами А, Г, Ц и Т. Эти буквы составляют алфавит генетического кода. В РНК используются те же нуклеотиды, за исключением тимина, который заменён похожим нуклеотидом - урацилом, который обозначается буквой U (У в русскоязычной литературе). В молекулах ДНК и РНК нуклеотиды выстраиваются в цепочки и, таким образом, получаются последовательности генетических букв.
Для построения белков в природе используется 20 различных аминокислот. Каждый белок представляет собой цепочку или несколько цепочек аминокислот в строго определённой последовательности. Эта последовательность определяет строение белка, а следовательно все его биологические свойства. Набор аминокислот также универсален для почти всех живых организмов.
Реализация генетической информации в живых клетках (то есть синтез белка, кодируемого геном) осуществляется при помощи двух матричных процессов: транскрипции (то есть синтеза иРНК на матрице ДНК) и трансляции генетического кода в аминокислотную последовательность (синтез полипептидной цепи на матрице иРНК). Для кодирования 20 аминокислот, а также сигнала «стоп», означающего конец белковой последовательности, достаточно трёх последовательных нуклеотидов. Набор из трёх нуклеотидов называется триплетом. Принятые сокращения, соответствующие аминокислотам и кодонам, изображены на рисунке.
Свойства генетического кода
Триплетность - значащей единицей кода является сочетание трёх нуклеотидов (триплет, или кодон).
Непрерывность - между триплетами нет знаков препинания, то есть информация считывается непрерывно.
Неперекрываемость - один и тот же нуклеотид не может входить одновременно в состав двух или более триплетов. (Не соблюдается для некоторых перекрывающихся генов вирусов, митохондрий и бактерий, которые кодируют несколько белков, считывающихся со сдвигом рамки).
Однозначность - определённый кодон соответствует только одной аминокислоте. (Свойство не является универсальным. Кодон UGA у Euplotes crassus кодирует две аминокислоты - цистеин и селеноцистеин)
Вырожденность (избыточность) - одной и той же аминокислоте может соответствовать несколько кодонов.
Универсальность - генетический код работает одинаково в организмах разного уровня сложности - от вирусов до человека (на этом основаны методы генной инженерии) (Из этого свойства также есть ряд исключений, см. таблицу в разделе "Вариации стандартного генетического кода" в данной статье).
16.Условия биосинтеза
Для биосинтеза белка необходима генетическая информация молекулы ДНК; информационная РНК - переносчик этой информации из ядра к месту синтеза; рибосомы - органоиды, где происходит собственно синтез белка; набор аминокислот в цитоплазме; транспортные РНК, кодирующие аминокислоты и переносящие их к месту синтеза на рибосомы; АТФ - вещество, обеспечивающее энергией процесс кодирования и биосинтеза.
Этапы
Транскрипция - процесс биосинтеза всех видов РНК на матрице ДНК, который протекает в ядре.
Определенный участок молекулы ДНК деспирализуется, водородные связи между двумя цепочками разрушаются под действием ферментов. На одной цепи ДНК, как на матрице, по принципу комплементарное из нуклеотидов синтезируется РНК-копия. В зависимости от участка ДНК таким образом синтезируются рибосомные, транспортные, информационные РНК.
После синтеза иРНК она выходит из ядра и направляется в цитоплазму к месту синтеза белка на рибосомы.
Трансляция - процесс синтеза полипептидных цепей, осуществляемый на рибосомах, где иРНК является посредником в передаче информации о первичной структуре белка.
Биосинтез белка состоит из ряда реакций.
1. Активирование и кодирование аминокислот. тРНК имеет вид клеверного листа, в центральной петле которого располагается триплет-ный антикодон, соответствующий коду определенной аминокислоты и кодону на иРНК. Каждая аминокислота соединяется с соответствующей тРНК за счет энергии АТФ. Образуется комплекс тРНК-аминокислота, который поступает на рибосомы.
2. Образование комплекса иРНК-рибосома. иРНК в цитоплазме соединяется рибосомами на гранулярной ЭПС.
3. Сборка полипептидной цепи. тРНК с аминокислотами по принципу комплементарности антикодона с кодоном соединяются с иРНК и входят в рибосому. В пептидном центре рибосомы между двумя аминокислотами образуется пептидная связь, а освободившаяся тРНК покидает рибосому. При этом иРНК каждый раз продвигается на один триплет, внося новую тРНК - аминокислоту и вынося из рибосомы освободившуюся тРНК. Весь процесс обеспечивается энергией АТФ. Одна иРНК может соединяться с несколькими рибосомами, образуя полисому, где идет одновременно синтез многих молекул одного белка. Синтез заканчивается, когда на иРНК начинаются бессмысленные кодоны (стоп-коды). Рибосомы отделяются от иРНК, с них снимаются полипептидные цепи. Так как весь процесс синтеза протекает на гранулярной эндо-плазматической сети, то образовавшиеся полипептидные цепи поступают в канальца ЭПС, где приобретают окончательную структуру и превращаются в молекулы белка.
Все реакции синтеза катализируются специальными ферментами с затратой энергии АТФ. Скорость синтеза очень велика и зависит от длины полипептида. Например, в рибосоме кишечной палочки белок из 300 аминокислот синтезируется приблизительно за 15-20 с.
Является синтез белковой молекулы на основе матричной РНК (трансляция). Однако в отличие от транскрипции нуклеотидная последовательность не может быть переведена в аминокислотную напрямую, так как эти соединения имеют разную химическую природу. Поэтому для осуществления трансляции требуется посредник в виде транспортной РНК (тРНК), функция которого состоит в переводе генетического кода на "язык" аминокислот.
Общая характеристика транспортной РНК
Транспортные РНК или тРНК - это небольшие молекулы, которые доставляют аминокислоты к месту синтеза белка (в рибосомы). Количество этого вида рибонуклеиновой кислоты в клетке составляет примерно 10 % от общего пула РНК.
Как и другие разновидности тРНК состоит из цепочки рибонуклеозидтрифосфатов. Длина нуклеотидной последовательности насчитывает 70-90 звеньев, и около 10 % состава молекулы приходится на минорные компоненты.
Из-за того, что каждой аминокислоте соответствует свой переносчик в виде тРНК, клетка синтезирует большое количество разновидностей этой молекулы. В зависимости от вида живого организма этот показатель варьирует от 80 до 100.
Функции тРНК
Транспортная РНК является поставщиком субстрата для белкового синтеза, который происходит в рибосомах. За счет уникальной способности связываться и с аминокислотами, и с матричной последовательностью тРНК выполняет функцию смыслового адаптера при переводе генетической информации из формы РНК в форму белка. Взаимодействие такого посредника с кодирующей матрицей, как в транскрипции, основано на принципе комплементарности азотистых оснований.
Главная функция тРНК заключается в акцептировании аминокислотных звеньев и их транспортировке в аппарат белкового синтеза. За этим техническим процессом стоит огромный биологический смысл - реализация генетического кода. Осуществление этого процесса основано на следующих особенностях:
- все аминокислоты кодируются триплетами нуклеотидов;
- для каждого триплета (или кодона) существует антикодон, входящий в состав тРНК;
- каждая тРНК может связаться только с определенной аминокислотой.

Таким образом, аминокислотная последовательность белка определяется тем, какие тРНК и в каком порядке будут комплементарно взаимодействовать с матричной РНК в процессе трансляции. Это возможно благодаря наличию в транспортной РНК функциональных центров, один из которых отвечает за избирательное присоединение аминокислоты, а другой - за связывание с кодоном. Поэтому функции и тесно взаимосвязаны.
Строение транспортной РНК
Уникальность тРНК заключается в том, что ее молекулярная структура не линейна. Она включает в себя спиральные двуцепочечные участки, которые называют стеблями, и 3 одноцепочечные петли. По форме такая конформация напоминает клеверный лист.
В структуре тРНК различают следующие стебли:
- акцепторный;
- антикодоновый;
- дигидроуридиловый;
- псевдоуридиловый;
- добавочный.
Двойные спирали стеблей содержат от 5 до 7 Уотсон-Криксоновских пар. На конце акцепторного стебля расположена небольшая цепочка неспаренных нуклеотидов, 3-гидроксил которой является местом прикрепления соответствующей молекулы аминокислоты.

Структурной областью для соединения с мРНК служит одна из петель тРНК. Она содержит антикодон, комплементарный смысловому триплету в Именно антикодон и акцептирующий конец обеспечивают адапторную функцию тРНК.
Третичная структура молекулы
"Клеверный лист" является вторичной структурой тРНК, однако за счет фолдинга молекула приобретает L-образную конформацию, которая скрепляется дополнительными водородными связями.
L-форма представляет собой третичную структуру тРНК и состоит из двух практически перпендикулярных А-РНК спиралей, имеющих длину 7 нм и толщину 2 нм. Такая форма молекулы имеет всего 2 конца, на одном из которых расположен антикодон, а на другом - акцепторный центр.

Особенности связывания тРНК с аминокислотой
Активацию аминокислот (их присоединение к транспортной РНК) осуществляет аминоацил-тРНК-синтетаза. Этот фермент одновременно выполняет 2 важных функции:
- катализирует образования ковалентной связи между 3`-гидроксильной группой акцепторного стебля и аминокислотой;
- обеспечивает принцип избирательного соответствия.
Для каждой из есть своя аминоацил-тРНК-синтетаза. Она может взаимодействовать только с соответствующим видом транспортной молекулы. Это означает, что антикодон последней должен быть комплементарен триплету, кодирующему именно эту аминокислоту. Например, синтетаза лейцина будет соединяться только с предназначеным для лейцина тРНК.
В молекуле аминоацил-тРНК-синтетазы есть три нуклеотид-связывающих кармана, конформация и заряд которых комплементарны нуклеотидам соответствующего антикодона в тРНК. Таким образом, фермент определяет нужную транспортную молекулу. Гораздо реже фрагментом опознавания служит нуклеотидная последовательность акцепторного стебля.
Молекулы РНК в отличие от ДНК построены из одной полинуклеотидной цепи. Однако в этой цепи (для рРНК и мРНК) имеются комплементарные друг другу участки, которые могут взаимодействовать, образуя двойные спирали. При этом соединяются водородными связями нуклеотидные пары А-У и Г-Ц. Такие спирализованные участки (их называют шпильками) обычно содержат небольшое количество нуклеотидных пар (до 20-30) и чередуются с неспирализованными участками.
Характерную вторичную структуру имеют тРНК. Они содержат четыре спирализованных участка и три (четыре) одноцепочные петли. При изображении такой структуры на плоскости получается фигура, называемая «клеверным листом» (рис. справа).
Рис.. Вторичная (справа) и третичная (слева) структура тРНК
Все несколько десятков разных тРНК клетки имеют общий план пространственной структуры, но различаются в деталях. В тРНК выделяют следующие структурные участки.
1. Акцепторный конец - во всех типах тРНК имеет состав ЦЦА. К гидроксилу З"-ОН аденозина карбоксильной группой присоединяется аминокислота, которую данная тРНК доставляет к рибосомам, где происходит синтез белка.
2. Антикодоновая петля - содержит специфический для каждой тРНК триплет нуклеотидов (антикодоны). Антикодон комплементарен кодону мРНК. Кодон-антикодоновое взаимодействие определяет порядок чередования аминокислот в белковой молекуле при синтезе ее на рибосомах.
3. Псевдоуридиловая петля (Г,С) - участвует в связывании тРНК с рибосомой.
4. Дигидроуридиловая (D) петля необходима для связывания с ферментом аминоацил-тРНК-синтетзой, которая участвует в узнавании аминокислотой своей тРНК.
5. Добавочная петля - разная у разных тРНК.
Третичная структура рнк и днк
Пространственная конфигурация спирализованной полинуклеотидной цепи (третичная структура) достаточно полно выяснена для молекул РНК. Установлено, что нативные молекулы тРНК имеют примерно одинаковую третичную структуру, которая отличается от плоской структуры «клеверного листа» (вторичная структура) большей компактностью за счет складывания различных частей молекулы (см. рис выше).
Для рРНК и мРНК возможно существование, а зависимости от концентрации солей и температуры, трех видов третичной структуры (рис. ниже). Первый - рыхлый беспорядочный клубок или распрямленная цепь (при повышении температуры и отсутствии солей). Второй вариант - компактный клубок с двуспиральными участками (высокая ионная сила, комнатная температура). Третий вид - компактная палочка с упорядочение ориентированными двуспиральными участками (низкая ионная сила, комнатная температура). Все три типа третичной структуры РНК связаны взаимными переходами.
Третичная структура ДНК зависит от того, сколько цепочек полинуклеотидов (одна или две) в ДНК. В ряде вирусов обнаружены одноцепочечные ДНК линейной и кольцевой формы. Двуцепочечные спиралевидные молекулы ДНК также могут существовать в линейной и кольцевой форме; образование последней вызвано ковалентным соединением их открытых концов.

Рис. Третичная структура: А - ДНК: 1 - линейная одноцепочечная бактериофаг ФХ174 (и др. вирусов); 2 - кольцевая одноцепочечная ДНК вирусов и митохондрий; 3 - кольцевая двойная спираль ДНК; Б - РНК: 1 - рыхлый клубок или распрямленная цепь; 2 - компактная палочка; 3 - компактный клубок
Кроме того, полагают, что биспиральные молекулы ДНК существуют в хромосомах в виде вторично спирализованных фрагментов, связанных друг с другом (суперспираль). Поэтому молекулярный вес нативной ДНК достигает нескольких сотен миллионов. Следовательно, молекулы с молекулярной массой 10.000.000 являются субъединицами более крупных молекулярных образований (третичная структура). Именно суперспирализация обеспечивает экономную упаковку огромной молекулы ДНК в хромосоме: вместо 8 см длины, которую она могла бы иметь в вытянутой форме, она занимает всего 5 нм.